 La pandemia in corso di COVID-19 ha imposto alla comunità scientifica di dedicarsi alla ricerca e sviluppo di varie strategie per combattere l’infezione da SARS-CoV-2.
La pandemia in corso di COVID-19 ha imposto alla comunità scientifica di dedicarsi alla ricerca e sviluppo di varie strategie per combattere l’infezione da SARS-CoV-2.
L’unico modo informato per identificare nuovi antivirali passa attraverso la conoscenza della struttura tridimensionale, letteralmente la forma, delle proteine del virus che sono responsabili dell’infezione delle cellule e della replicazione del virus. Una volta nota la struttura delle proteine, è possibile per i chimici sintetizzare dei composti che ne bloccano la funzione, e di conseguenza il ciclo vitale del virus.
Ne parliamo in questo ciclo di 5 puntate con l’aiuto del Dott. Massimo Degano, Group leader dell’Unità di Biocristallografia dell’IRCCS Ospedale San Raffaele e docente presso il nostro Ateneo (insegna Chimica al Corso di Laurea in Odontoiatria e Protesi dentaria e all’International MD Program, Biochimica al Corso di Laurea in Medicina, e Biologia strutturale al Corso di Laurea in Ricerca Biotecnologica in Medicina).

Struttura della proteina Spike da SARS-CoV-2. Due catene sono rappresentate tramite la superficie molecolare che evidenzia la forma generale della molecola. La catena S1 è colorata in verde, con in rosso la porzione che serve ad interagire con il recettore ACE2 per infettare le cellule. La catena S2, che contiene la parte della molecola necessaria per l’ingresso del virus nella cellula, è colorata in giallo. Per gentile concessione del Dott. Degano.
A cosa serve visualizzarne la struttura?
Perché vedere la struttura di una proteina è essenziale per sviluppare nuovi farmaci? Immaginate di dover svitare un bullone e non avere le chiavi inglesi a disposizione: se vedete la forma del bullone e le sue dimensioni sarete in grado di forgiare (o di scegliere) la chiave delle dimensioni corrette per riuscire nel vostro scopo. Analogamente, quando è visibile la struttura di una proteina si può ingegnerizzare la molecola con le dimensioni e la forma che possa legarsi in modo ottimale ad essa e bloccarne la funzione.
Le tecniche che ci consentono di “mettere a fuoco” al meglio le strutture di proteine ed apprezzare con il maggior dettaglio come sono fatte sono essenzialmente due: la cristallografia a raggi X e la criomicroscopia elettronica.

- Nella cristallografia a raggi X, le molecole delle proteine si dispongono secondo un reticolo ordinato e simmetrico, e quando vengono irradiate da un fascio molto intenso di raggi X emettono a loro volta radiazione che può essere misurata: tramite calcoli al computer, possono dirci esattamente come sono distribuiti gli elettroni attorni agli atomi nel cristallo (la densità elettronica);
- nella criomicroscopia elettronica, molecole singole vengono irradiate con elettroni che tramite lenti sofisticatissime vengono focalizzati per darci analogamente l’immagine della densità elettronica. Grazie a questa informazione, visualizzabile con dei programmi di grafica al PC, per i biologi strutturali si tratta di risolvere un puzzle inserendo gli amminoacidi che compongono la proteina nella densità elettronica e ricostruire la struttura della proteina.
Spike e RBD-ACE2
Nel giro di due mesi dai primi casi di COVID-19, due gruppi di ricerca hanno determinato in modo indipendente la struttura della proteina Spike utilizzando la criomicroscopia elettronica [1],[2], facendo vedere che essa è costituita da tre catene uguali associate (si dice che è “trimerica”) e costituita da una regione che somiglia al gambo di un fiore con, al posto della corolla, la regione essenziale per il contatto con le cellule da infettare (chiamato RBD, dall’inglese receptor-binding domain, “dominio che lega il recettore”). Questa parte della molecola è flessibile come una banderuola al vento, ed è in grado di “cercare” nei dintorni il recettore ACE2 con cui interagire. In seguito, è stata visualizzata tramite cristallografia la struttura di ACE2 legata a Spike [3], mostrando con un dettaglio elevatissimo la modalità con cui il virus si attacca alla cellula da infettare.
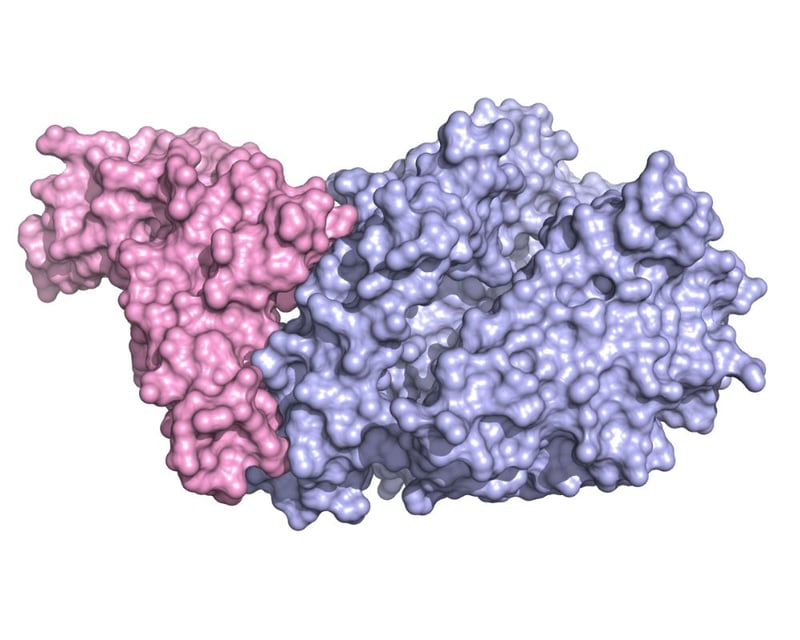 La struttura cristallografica del dominio che lega il recettore (RBD, colorato in rosa) di Spike unito alla parte extracellulare dell’enzima ACE2 (in blu chiaro) mostra in dettaglio quali parti delle due molecole sono coinvolte nell’adesione tra virus e cellula. Per gentile concessione del Dott. Degano.
La struttura cristallografica del dominio che lega il recettore (RBD, colorato in rosa) di Spike unito alla parte extracellulare dell’enzima ACE2 (in blu chiaro) mostra in dettaglio quali parti delle due molecole sono coinvolte nell’adesione tra virus e cellula. Per gentile concessione del Dott. Degano.
La sfida ora è utilizzare questa conoscenza per trovare molecole in grado di legarsi a Spike, tenendo impegnata la parte che dovrebbe interagire con ACE2 e prevenendo quindi l’infezione.
Vuoi rimanere costantemente aggiornato sullo svolgimento delle attività didattiche di UniSR in conformità alla normativa vigente per la sicurezza durante l'emergenza Covid-19? Visita la sezione dedicata della nostra Knowledge Base e segnalaci tutte le domande che vorresti chiederci

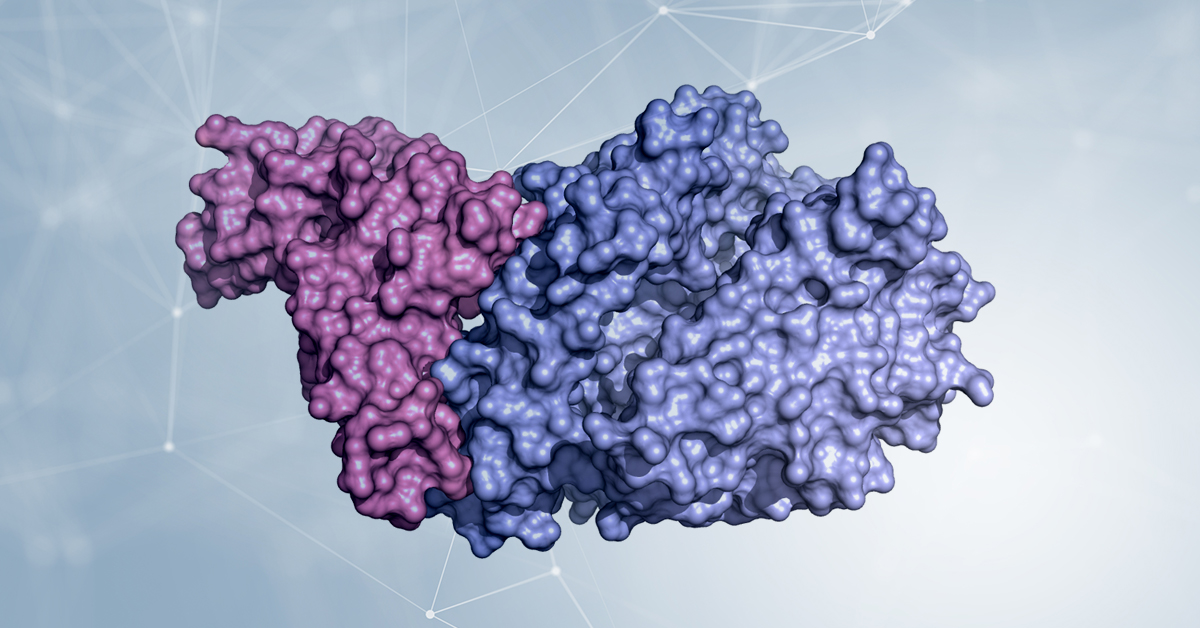



 La struttura cristallografica del dominio che lega il recettore (RBD, colorato in rosa) di Spike unito alla parte extracellulare dell’enzima ACE2 (in blu chiaro) mostra in dettaglio quali parti delle due molecole sono coinvolte nell’adesione tra virus e cellula. Per gentile concessione del Dott. Degano.
La struttura cristallografica del dominio che lega il recettore (RBD, colorato in rosa) di Spike unito alla parte extracellulare dell’enzima ACE2 (in blu chiaro) mostra in dettaglio quali parti delle due molecole sono coinvolte nell’adesione tra virus e cellula. Per gentile concessione del Dott. Degano.