La settimana scorsa abbiamo parlato della proteina Spike del SARS-CoV-2, la cui struttura è stata determinata tramite criomicroscopia elettronica (cryo-EM). Ma in cosa consiste questa tecnica che consente di osservare con dettaglio atomico la struttura di molecole di dimensioni infinitesime?
La microscopia elettronica è sostanzialmente simile alla microscopia ottica, che funziona irradiando un oggetto con luce visibile e raccoglie i raggi deviati dall’oggetto e focalizzando questi raggi tramite delle lenti sulla retina dell’occhio o su uno schermo.
Una risoluzione altissima
Utilizzando obiettivi adeguati possiamo ingrandire l’immagine per apprezzare i dettagli più fini. Qui entra in gioco il termine “risoluzione”, ovvero la capacità di vedere come distinti due oggetti ad una distanza minima. L’occhio umano ha una risoluzione di 0.1 millimetri.
Con i microscopi ottici che sfruttano la luce visibile è possibile raggiungere una risoluzione di 0.2 micrometri, cioè 500 volte maggiore. Questa risoluzione consente di vedere singole cellule, ma non oggetti più piccoli quali virus, proteine e altre molecole biologiche.
Per “vedere” oggetti ancora più piccoli, occorre utilizzare qualcosa di diverso dalla luce visibile: gli elettroni. Gli elettroni, particelle subatomiche e quindi molto più piccole persino delle molecole che vogliamo visualizzare, vengono deviati dal loro cammino dagli atomi delle molecole, esattamente come la luce viene deviata dagli spigoli di un oggetto. Con delle lenti molto specifiche, fatte non di materiali solidi ma costituite da campi elettrici, possiamo focalizzare gli elettroni e ottenere l’immagine delle molecole.

Esempio di immagine di un campione contenente molecole di una proteina ottenute al microscopio elettronico. Si possono vedere le singole particelle delle molecole. Ingrandendo l’immagine si può ottenere un dettaglio atomico. Per gentile concessione del Dott. Degano.
Detta così, sembra una tecnica banale. Ma ci sono tante problematiche tecniche che per anni ne hanno limitato l’uso:
- primo fra tutti, le molecole nel campione si muovono, perciò l’immagine che otteniamo è “mossa” come in una fotografia, limitando di molto la risoluzione;
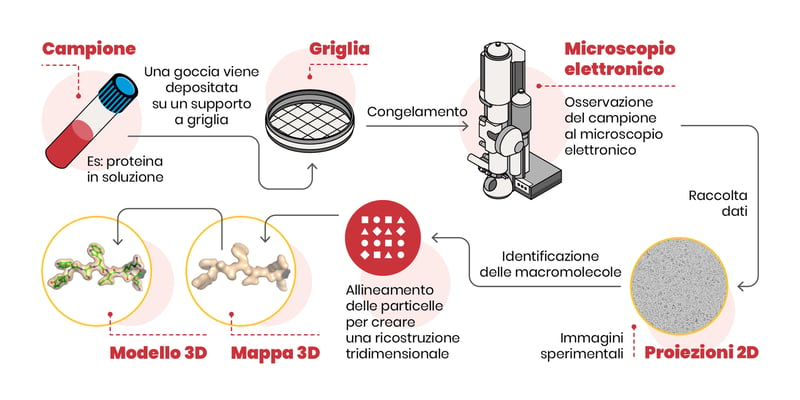
- secondo, gli elettroni sono particelle con elevata energia e danneggiano le molecole che “illuminano”. Tutto questo è stato superato dall’introduzione della criomicroscopia elettronica, in cui il campione viene raffreddato a -173.15 °C: l’acqua a questa temperatura forma una specie di vetro che consente di immobilizzare le molecole e riduce anche il danno causato dagli elettroni (scoperta premiata con il Premio Nobel). Lo schema dell’esperimento di microscopia elettronica è mostrato qui a seguire.
Fotografare l'oggetto orientato in modi diversi
Resta un’ultima difficoltà: noi riusciamo ad apprezzare l’immagine tridimensionale di un oggetto anche perché possiamo girarci attorno e guardarlo da più angolazioni. Nella cryo-EM si fotografa l’oggetto (la molecola) orientato in tanti modi diversi.
Quindi, le immagini 2D delle molecole orientate casualmente nello spazio vengono utilizzate per ricostruire, tramite algoritmi sofisticati al computer, la forma 3D della molecola. Ora tocca ai biochimici interpretare la densità elettronica e costruire il modello della proteina! Ma di questo “videogioco” parleremo in una delle prossime puntate.
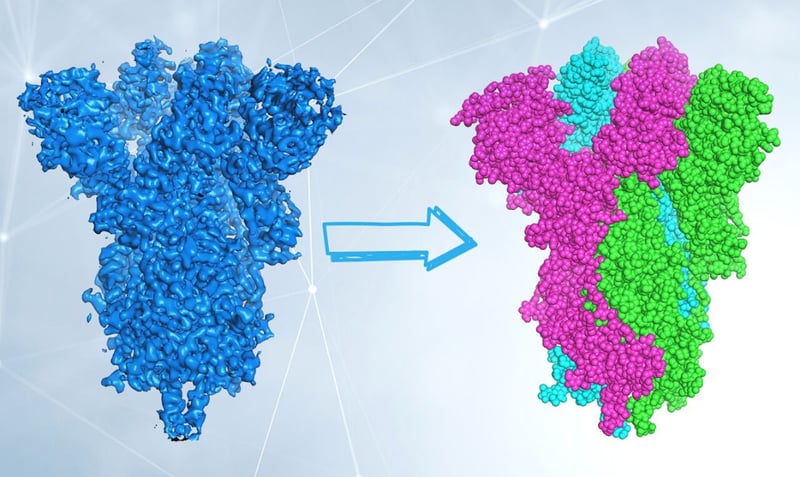
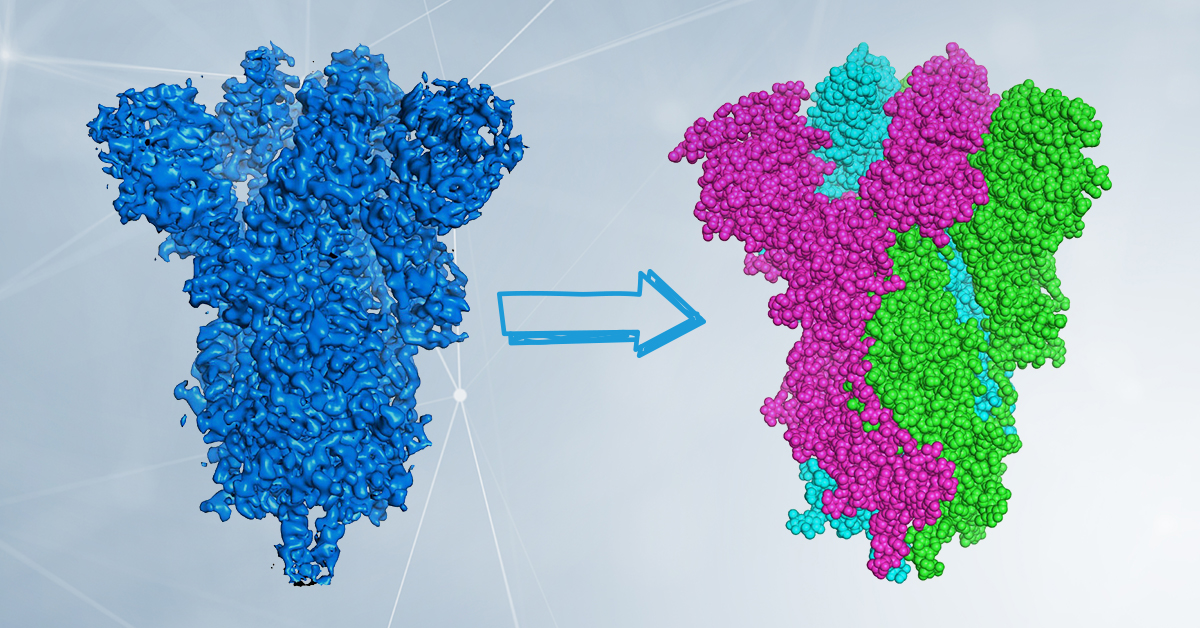
A sinistra, colorata in blu, è rappresentata la densità elettronica della proteina Spike da SARS-CoV-2 ottenuta tramite cryo-EM. A destra, la struttura della proteina, che come ormai sapete è composta da tre catene uguali (trimerica), rappresentata da una sferetta per ogni atomo che la compone. La struttura si determina inserendo nella densità elettronica la sequenza di amminoacidi che compongono la proteina stessa. I dati sperimentali derivano dall’Electron Microscopy Data Bank e dal Protein Data Bank, codici di accesso emd_20078 e 6X6P. Per gentile concessione del Dott. Degano.
La criomicroscopia elettronica è una tecnica all’avanguardia ed estremamente potente, e in pochi anni ha consentito di determinare la struttura di molecole che per anni rappresentavano il frutto inarrivabile per tanti studiosi. Come detto nell’articolo precedente, la struttura della proteina Spike di SARS-CoV-2 è stata determinata in un paio di mesi e ha consentito di capire come interagisce con il recettore cellulare ACE2.
Come ogni tecnica, ha comunque i suoi limiti: le molecole oggetto di studio, ad esempio, devono essere piuttosto grandi. Altro limite, non trascurabile, il costo degli strumenti e della loro continua manutenzione.
Sei un appassionato di Biologia Molecolare? Scopri il Dottorato di Ricerca Internazionale in Medicina Molecolare di UniSR e contribuisci alla ricerca sui processi molecolari alla base delle malattie umane per l'elaborazione di nuove terapie